
تصميم الأدوية ضد الفيروسات باستهداف مراحل مضاعفة الحمض النووي و تحرير الارتباط: مقارنة بين فيروسات كورونا “كوفيد-19” و “الإيدز” والأنفلونزا
مقدمة
أنتج وباء داء الفيروسات التاجية لعام 2019 (COVID-19) الخوف والاضطراب، إثر الانتقال السريع للعدوى وصعوبة السيطرة عليه في الشهور الأولى من ظهوره. مباشرة بدأ التفكير في إيجاد لقاح ودواء لإيقاف الجائحة. ورغم أن هذا يتطلب، قبل كل شيء، المعرفة الشاملة للفيروس والميكانيزمات البيوكيميائية للعدوى، فقد وقع ارتباك كبير في كل المجتمعات أخذا بعين الاعتبار الانتشار السريع للفيروس ومتطلبات البحث العلمي من تجارب متعددة وطويلة الأمد. في هذا المناخ بدأت بشكل سريع تجربة أدوية سابقة أبانت فاعليتها في علاج أمراض أخرى بعيدة أو قريبة من وباء “كورونا”. هكذا بدأ الحديث عن استعمال دواء “هيدروكسي كلوروكين” (Hydroxychloroquin)، الذي يعالج أصلا الملاريا، و دواء “ريمديسيفير” (remdesivir) الذي يستعمل ضد مرض “إيبولا”. لِمَ لا نجرب و تاريخ الأدوية علَّمَنا أن العديد من الأدوية كانت مصممة لعلاج مرض معين، فأصبحت تستعمل في مكافحة أمراض مختلفة. وكمثال حي دواء “أزيدوثيميدين” (AZT) الذي يستعمل حاليا لمكافحة فيروس نقص المناعة البشرية (AIDS) وكان صمما أصلا لعلاج السرطان.
في انتظار وجود لقاح أو دواء ناجع ضد فيروس “كورونا” “كوفيد-19″، يجب نهج الوقاية أولا. على هذا النحو، يجب أن يلهمنا انتشار هذا الفيروس التاجي التفكير في تجربة محاربة فيروس نقص المناعة البشرية على مدى السنوات الأربعين الماضية. كما هو الحال مع فيروس (AIDS)، فإن الطريق إلى الحد من العدوى بفيروس كورونا “كوفيد-19″، يتطلب استراتيجيات طبية وغير طبية. ففي بداية وباء “الإيدز” حدثت تغييرات في السلوك الجنسي و تدخلت الحكومات في إغلاق ‘النقاط الساخنة’ لانتقال فيروس نقص المناعة البشرية مثل الحمامات و مجالات أخرى. بالنسبة لـ “كورونا”، أظهر الحجر الصحي في المنازل واستعمال الأقنعة والقفازات ونظافة الأيدي انعكاسات إيجابية في حد العدوى، في انتظار لقاح أو دواء ناجع.
إن تقليص العدوى جراء كل هذه السلوكيات قد يتأتى باستعمال العقاقير المضادة للفيروسات، والتي تقلل من شدة العدوى و تمنع الانتقال المستمر (انقطاع التكاثر الفيروسي يوفر أيضا فائدة وقائية). مكن العلاج الأول لفيروس نقص المناعة البشرية “أزيدوثيميدين” (AZT)، من تمديد عمري يصل إلى 18 شهرا، مما وفر الأمل في أن تتحول عدوى فيروس نقص المناعة البشرية من “حكم بالإعدام” إلى مرض قابل للعلاج. هكذا كان الحد من خطر انتقال العدوى من الأم إلى الطفل باستعمال (AZT) كأول وقاية طبية حيوية ضد انتقال فيروس نقص المناعة البشرية. كان هذا النجاح مقدمة ل “العلاج الوقائي”، حيث تقلل العقاقير المضادة للفيروسات الحمل الفيروسي لفيروس “الإيدز” إلى مرحلة يصير فيها الأشخاص المصابون لا ينقلونه. بالنسبة ل (SARS-CoV-2)، أظهرت النتائج الأولية من تجربة عشوائية كبيرة مضبوطة أن العقار المضاد للفيروسات، “ريمديسيفير” (Remdesivir) يقلل بشكل كبير من مدة الاستشفاء لـ (COVID-19). تفضي هذه التجربة إلى إمكانية أن تصبح العقاقير المضادة للفيروسات طويلة المفعول والأجسام المضادة وحيدة النسيلة (Monoclonal antibodies) التي تحيد (SARS-CoV-2)، أدوات دوائية غير سامة للوقاية.
مراحل العدوى عند الفيروسات
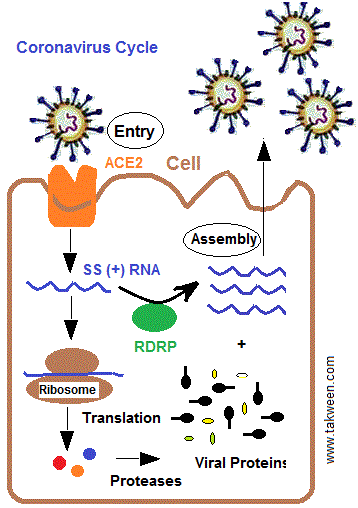
قبل التطرق لصنع العقاقير، يجب تدقيق مرحلة عدوى الفيروس للخلية حتى يتم التدخل بنجاعة. هناك ست مراحل للعدوى تبدأ بالارتباط (Attachment) يليه الاختراق أو الدخول (Entry, Penetration, Uncoating) و نزع “الكابسيد” (Decapsidation) و مضاعفة الحمض النووي (Replication) والتغليف (Packaging, Assembly) والتحرر (size: Release).
كل عقار يصمم إلا و يستهدف مرحلة معينة من بين المراحل الستة. لكن قبل البدء في التصميم والتصنيع يجب معرفة الميكانيزمات التي تتميز بها كل مرحلة. يعرف الباحثون في المختبرات المبادئ البيوكيميائية في العدوى لكل مرحلة. فمرحلة الارتباط تتطلب وجود مستقبلات خاصة بالفيروس محمولة بالخلية المضيفة، والتي تنتمي إلى أنواع معينة من الخلايا أو الأنسجة، وبالتالي فإن المستقبل يعتبر محددا حاسما في مدار الفيروس. لهذا نجد أن بعض الفيروسات لا يمكنها أن تصيب الإنسان وتصيب الطيور لوجود مستقبلات خاصة عند هذه الأخيرة. على سبيل المثال، يستخدم فيروس “الإيدز” جزيء (CD4) لبعض الخلايا اللمفاوية التائية والبلعميات ، كمستقبل ترتبط به “جليكوبروتينات” من نوع (gp120) الذي يوجد بسطح غلاف الفيروس. طبيعيا، جزيء (CD4) ضروري لعمل الخلايا الليمفاوية (CD4 + T)، إذ يسمح لها بالتفاعل مع جزيئات مركب التطابق النسيجي.
فيما يخص فيروسات الزكام (أنفلونزا)، فهي تعدي أغشية القصبة الهوائية لأنها حاملة للحمض السيالي (Sialic acid) بوصفه مُستقبِلا يرتبط به الفيروس. بعد التكاثر يبقى الفيروس معلقا بالخلية المضيفة حتى يستعمل أنزيم “نورامينيداز” (Neuraminidase) الذي يتوفر عليه ليفك ارتباطه و ينتقل إلى خلية جديدة.
بإمكان العقاقير أن تصمم لتحدث خللا في مضاعفة الحمض النووي للفيروس وفي هذا الإطار يجب التمييز بين الأحماض النووية للفيروسات، هل هي من نوع “د ن أ” (DNA) أو “ر ن أ” (RNA). تمتاز فيروسات “الإيدز” و”كوفدي” بحمض “ر ن أ” (فيروسات قهقرية، Retrovirus).
للتذكير، يمكن فقط للفيروسات ب (DNA) أن تتضاعف في نواة الخلية باستخدام الإنزيمات الخلوية للنسخ. أما الفيروسات الأخرى فيجب أن يكون لديها إنزيمات خاصة بها. لهذا، تحتوي فيروسات الحمض النووي الريبي على دورة تكاثر سيتوبلازمية.
لا يوجد إنزيم نووي للخلية المضيفة يمكن أن يكون مفيدًا لها للتضاعف أو النسخ. لحد الآن، لم يتم اكتشاف أي أنزيم “بوليميراز” RNA-RNA (RNA-dependent RNA polymerase, replicase) قادر على نسخ مقاطع طويلة من (RNA) في خلايا الثدييات. لذا تقوم فيروسات (RNA) بتركيب “البوليميراز” الخاص بها. للتذكير، تستعمل الفيروسات ب “ر ن أ” ذات قطبية إيجابية (+) ك “ر ن أ” رسول يترجم مباشرة إلى بروتينات داخل “ريبوزومات” الخلية. أما الفيروسات ذات “ر ن أ” بقطبية سلبية (-)، فيجبر الفيروس على تركيب “ر ن أ” بقطبية إيجابية (+) بواسطة أنزيمه “ر ن أ” “بوليميراز” المعتمد على “ر ن أ”. آنذاك، يمكن تركيب البروتينات.
فيروس “كوفيد-19”. تصميم عقار (Remdesivir)
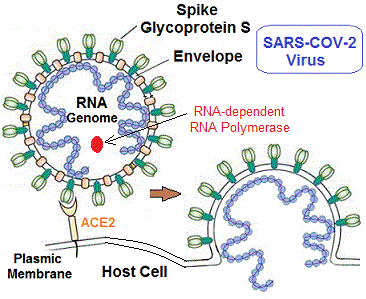
تعتبر فيروسات نقص المناعة البشرية و”السارس” (CoV – 2) فيروسات مختلفة جدا. يتم نقلها بشكل مختلف، وتتضاعف بشكل مختلف، لتسبب المرض بشكل مختلف .
يحتوي “كوفيد -19” على حمض نووي ريبي وحيد السلسلة (قطبية إيجابية +) مرتبط ببروتين نووي داخل كبسولة مؤلفة من بروتين “ماتريكس”. “كوفيد -19” ينتمي إلى الفيروسات التاجية التي تعد كبيرة ومغلفة داخل الغشاء الدهني، ولها “جينوم” كبير جدًا (حوالي 30000 “نيوكليوتيدات”). يعد أنزيم (RNA) “بوليميراز” المعتمد على (RNA) ، (RdRp) ، المسمى أيضًا (nsp12) المكون المركزي لآلة التضاعف / النسخ للفيروس، إذ يبدو هدفا أساسيا للعقاقير المضادة للفيروس.
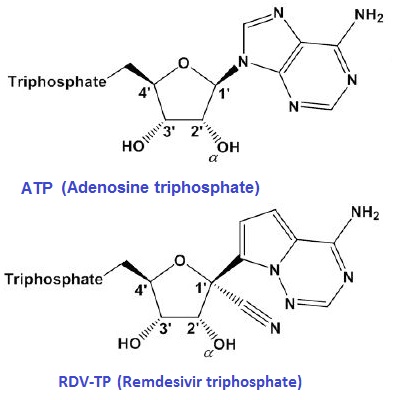
أظهرت الأبحاث أن العقار “ريمديسيفير” (Remdesivir, RDV, GS-5734) يظهر نشاطًا مضادا واسع النطاق ضد الفيروسات القهقرية. في شكله ثلاثي الفوسفات (RDV-TP) ، يعتبر (RDV) نظيرا “للأدينوزين ثلاثي الفوسفات” (ATP).
في عام 2016 تم تطوير (RDV) كدواء تجريبي من المختبر الأمريكي (Gilead Sciences) لعلاج المرضى الذين يعانون من حمى “الإيبولا” النزيفية.
في عام 2017 ، تم أيضا عرض نشاطه ضد عائلة الفيروسات التاجية، و الآن يتم البحث عن (Remdesivir) كعلاج محتمل للفيروس التاجي (COVID-19).
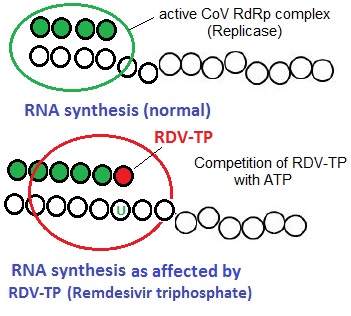
لقد كشفت دراسات حديثة أجريت على “ر ن أ بوليميراز” (أنزيم RdRps) لفيروس “إيبولا” (EBOV) والفيروس التاجي في الشرق الأوسط (MERS-CoV) أن آلية عمل “RDV” المحتملة تتجلى في وقف سلسلة “تبلمر النيكليوتيدات” حيث يقوم أنزيم (RdRps) بدمج (RDV) في شكله ثلاثي الفوسفات (RDV-TP) داخل (RNA) الفيروس، الشئ الذي يعيق متابعة البلمرة.
يبقى (Remdesivir) دواء موجها ضد تضاعف الحمض النووي الريبوزي لفيروس “كورونا”، حيث يتم استهداف مرحلة التضاعف و الإكثار في دورة الفيروس، علما أن هناك أدوية أخرى يتم تجريبها لاستهداف مراحل الارتباط و الدخول (تجرية أدوية “الكلوروكين” و”الهيدروكسي كلوروكين”).
حالة فيروس نقص المناعة البشرية. تصميم عقار AZT, Azidothymidine, Zidovudine, ZDV
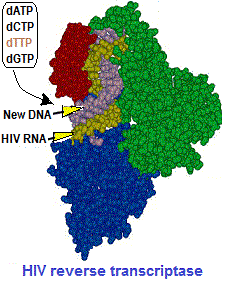
في حالة فيروس نقص المناعة البشرية، داخل سيتوبلازم الخلية المضيفة، يتم تحويل الحمض النووي الريبي الفيروسي (ر ن أ بقطبية إيجابية، +) إلى حمض نووي ريبوزي ناقص الأكسيجين (DNA) بواسطة أنزيم النسخ العكسي الذي يتوفر عليه. بعد هذا، يدخل (DNA) الجديد نواة الخلية ليستخدم آلية الخلية في الإكثار، حيث ينتج “ر ن أ” رسول (mRNA) لصنع البروتينات الفيروسية ثم “ر ن أ” الفيروس بذاته.
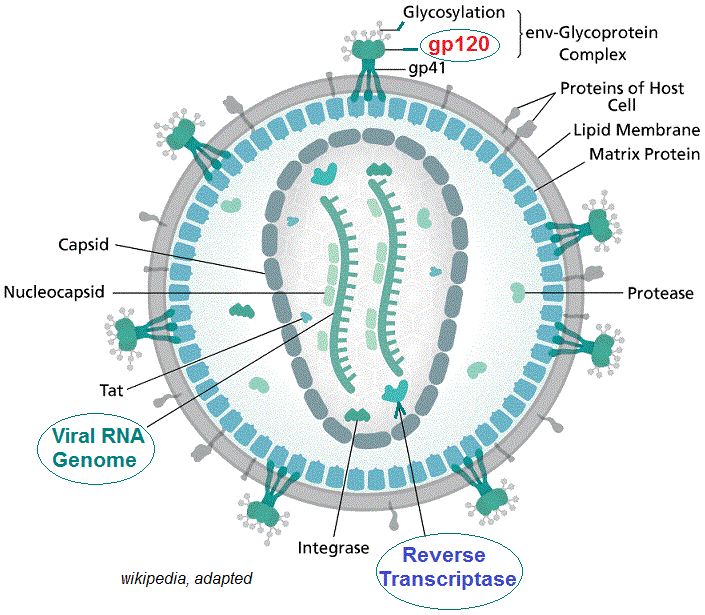
يعتبر عقار AZT (Azidothymidine, Zidovudine, ZDV) دواء مضادا للفيروسات القهقرية وشكل أول استخدام لعلاج عدوى فيروس نقص المناعة البشرية (AIDS). وهو مثبط للنسخ العكسي ل (RNA) الفيروس الذي يتم بواسطة أنزيم النسخ العكسي (Reverse transcriptase, RT) الذي يتوفر عليه الفيروس. يسوق (AZT) تحت اسم (Retrovir).
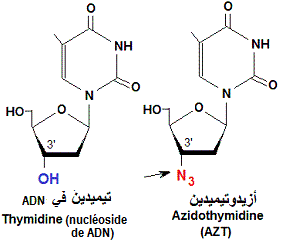
في الأصل صُمّم (AZT) لعلاج السرطان، لكنه لم يثبت فعاليته وكانت له آثار جانبية كبيرة. يعد (AZT) نظيرا ل”الثيميدين”، حيث تم استبدال مجموعة الكحول عند ‘3 فوق “الريبوز” ناقص الأكسيجين (deoxyribose) بمجموعة أزيد. بعد أن يدمج أنزيم (RT) جزئ (AZT) في السلسلة الجديدة ل (د ن أ) تتوقف عملية البلمرة و يحدث تثبيط للتكاثر الفيروسي.
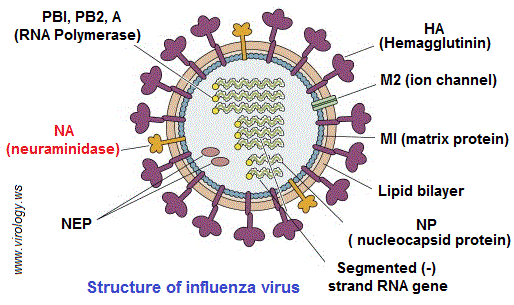
تحدد هذه البروتينات النوع الفرعي لفيروس الإنفلونزا (A / H1N1 كمثل). يشكل بروتين (NA) هدف الأدوية المضادة للفيروسات (Relenza) و (Tamiflu). عكس الفيروسات التي تقوم بتضاعف “ر ن أ” في “سيتوبلازم” الخلية المضيفة، يشكل فيروس الأنفلوانزا (“ر ن أ” بقطبية سلبية -) استثناء، حيث يتضاعف “ر ن أ” داخل نواة الخلية. يمتاز أنزيم “نورامينيداز” الفيروسي (Viral neuraminidase) بأهمية كبيرة في ارتباط الفيروس بالخلية المضيفة، إذ يوجد في غلاف فيروسات الإنفلونزا ويسمح لها بالانفصال عن الخلية. يقوم أنزيم “نورامينيداز” بفصل بقايا حمض “السياليك” (Sialic acid) عن البروتينات السكرية. أثناء تكاثره، يلتصق فيروس الإنفلونزا بسطح الخلية باستخدام “الهيماججلوتينين” (Hemagglutinin) ، الموجود على سطح الفيروس والذي يرتبط ببقايا حمض السياليك.
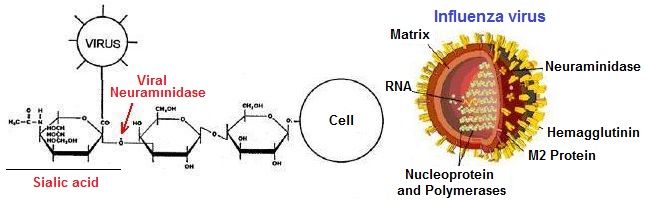
من أجل فك ارتباط الفيروسات الجديدة و السماح لها للانتقال إلى خلايا جديدة، يجب أن يتدخل أنزيم “النورامينيداز” الفيروسي لفك بقايا حمض السياليك من البروتينات السكرية التي ترتبط به. لذا فإن مثبطات “نورامنيديز” تعد معوقات أنزيمية (Enzyme inhibitors) مضادات للفيروسات وفعالة ضد الإنفلونزا البشرية لأنها تمنع تكاثر الفيروس. يعد أنزيم “النورامينيداز” ثاني بروتين سكري رئيسي موجود على سطح الفيروس. وهو عبارة عن مركب رباعي متجانس (homotetramer) يزن حوالي 240 كيلو دالتون ويظهر في شكل فطر. الرأس الكروي (200 كيلو دالتون) يرتبط بالقدم الذي يلج الغشاء الفيروسي. في أنزيم “النورامينيداز” تتفاعل ثمانية أحماض أمينية للموقع النشيط مباشرة مع مادة الأساس (الحمض السيالي) وهي: (Arg 292 ، Glu 276 ، Glu 277 ، Glu 119 ، Asp 151 ، Arg 152 ، Arg 118 و Tyr 406).
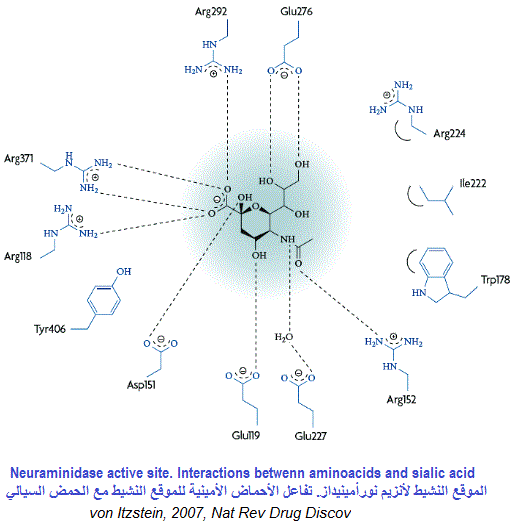
بعد ولوج الحمض السيالي للموقع النشيط للأنزيم، يتغير شكله من الكرسي إلى نصف الكرسي، ويتم تكوين أيون “أوكسوكربينيوم” بسبب التفاعلات الأيونية القوية بين “كربوكسيل” مادة الأساس ومجموعات “الغوانيديوم” في الأحماض الأمينية من نوع “أرجينين” رقم 118 ، 292 و 371 التي تنتمي إلى الأنزيم، مما يؤدي في النهاية إلى انشقاق الرابطة الجليكوزية. في بعض المرات قد تحدث طفرات في أنزيم “نوأمينيداز” للفيروس و يصبح مقاوما للأدوية الموجهة لكبح نشاط (NA). ففي يناير 2008 حصل هذا الوضع بشكل كبير، إذ طورت بعض فيروسات إنفلونزا (H1N1) مقاومة “للأوسيلتاميفير” بسبب طفرة (His274Tyr) في أنزيم (NA) ، وأصبحت المقاومة عند الفيروس في موسم الوباء من 2008-2009 تصل إلى 100 ٪.
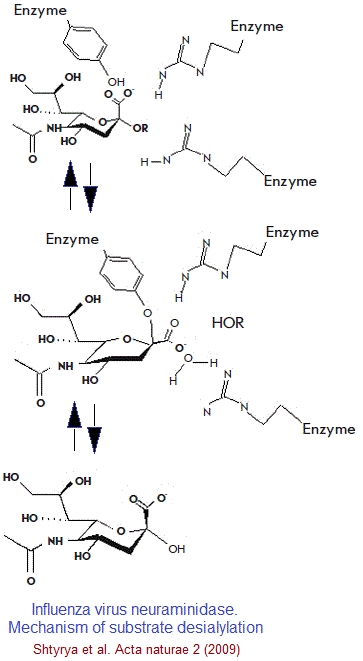
تبين للباحثين أن بنية الموقع النشيط ل “النورامينيداز” ثابت بشكل كبير، ليس فقط بين الأنواع الفرعية للفيروس، ولكن أيضا بين أنواع الأ نزيم، مما دفع الباحثين إلى تصميم مماثلات بنيوية لحمض “السياليك” لتثبيط نشاط الأنزيم. بحضور المثبط الأنزيمي (Oseltamivir) يتقلص النشاط الأنزيمي و يبقى الفيروس مرتبطا بسكريات الخلية المضيفة، وبالتالي لا يمكنه الانتقال إلى خلايا جديدة أخرى.
من بين العناصر الهيكلية الرئيسية لفئة من المثبطات (بدون ذرة الأكسجين في حلقة الحمض السيالي) هي “الهكسان” الحلقي “سيكلوهيكسان” و البنتان الحلقي “سيكلوبنتان” ا نطلاقا من ال “سيكلوهيكسان” ، جاءت فكرة “الأوزيلتاميفير” (Oseltamivir, TAMIFLU). بعدها تم تعديل بنية هذا الجزيء للتفاعل مع الأحماض الأمينية للموقع النشيط. حفز الاستخدام الناجح لهذا الدواء تطوير مثبطات (NA) جديدة بإدراج مجموعات نافرة للماء (Hydrophobic groups) في بنية الجزيء. موازاة مع تطوير المثبطات انطلاقا من “الهيكسان” الحلقي تم تطوير مثبطات (NA) على قاعدة هيكل “السيكلوبنتان” تحتوي على جميع الأجزاء المهمة وظيفيا والتي تتناسب مع الموقع النشيط للأنزيم. هكذا ظهر عقار (zanamivir).
مما لا شك فيه، يتطلب هذا العمل تعاونا قويا بين باحثي الكيمياء (كيمياء التخليق) و باحثي البيولوجيا (البيوكيمياء).